Tápanyagellátás beltérben II.
Vízminőség, vízkémia
Mezőgazdaságban általánosan elfogadott axioma az, hogy az a jó öntözővíz amit a ló megiszik. Kertészetekben, talaj nélküli termesztésben és beltéri növénytermesztésben ennél kicsivel szorosabb peremfeltételekben kell gondolkodni. Érdemes tudni a locsolásra szánt víz vezetőképességét, kémhatását és azt, hogy a víz amit használunk milyen, a növény által hasznosnak vagy károsnak minősülő anyagokat tartalmaz.
A szerves anyagok feleslegesen vannak a vízben, a növény nem tud velük mit kezdeni. A növény szervetlen anyagokat, sókat vesz fel a vízből oldott, ionos formában. Az ionok a sók vízben oldott formái. Az ionok töltésük szerint lehetnek
- kationok(+) Na+, K+, Ca2+, Mg2+, K+…
- anionok(-) Cl-, SO4– (szulfát-ion), NO3- (nitrát-ion), HCO3- (hidrogénkarbonát-ion)
EC
Ezek az ionok mennyisége határozza meg az öntözővíz összsótartalmát, vezetőképességét. Amikor mütrágyát -sókat- juttatunk a vízbe a víz ezeket felbontja pozitív és negatív töltésü ionokká, az oldat vezetőképessége nől.
Azokat az oldatokat, amelyeket sók alkotnak elektrolitoknak vagy sóoldatnak nevezzük. Ezek a sóoldatok elektromosan vezető tulajdonságúak és a sók mennyiségétől, a sóoldat töménységétől függ vezetőképességük. A több sót tartalmazó oldatok jobb vezetőképességűek, mint a híg sóoldatok, így az oldat vezetőképessége alapján következtetni lehet az oldat sótartalmára. A vezetőképességet –nevezzük a továbbiakban EC-nek (electrical conductivity)- mS/cm(milliSiemens/centimeter) mértékegységben kapjuk és értelmezzük.
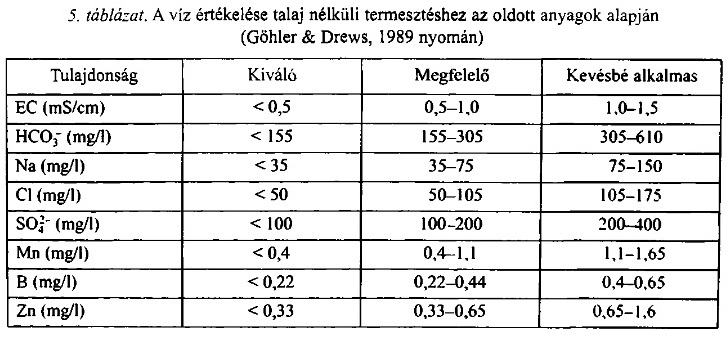
| Kiváló vizek | 0-0,5 mS/cm |
| Még alkalmas vizek | 0,5-1,5 mS/cm |
| Csak kintre alkalmas vizek | 1,5-2,0 mS/cm |
| Alkalmatlan vizek | 2,0 mS/cm felett. |
A növények szöveteiben található víz is tartalmaz ionokat, így annak is van EC-je. Ezek az ionok és maga a víz is a gyökereken keresztül jut be a növénybe és épül be a szövetekbe. Viszont a növény csak a saját EC-jénél hígabb oldatból tud felvenni további tápionokat és vizet így követelmény, hogy a locsolóvíz vagy tápoldat iontartalma/töménysége/EC-je alacsonyabb legyen, mint a növényé. Ebből következik, hogy minél alacsonyabb a locsolóvíz EC-je annál hasznosabb számunkra. A kevés iont/sót tartalmazó vizek egyben azt is megengedik, hogy több, a növény számára hasznos sót –műtrágyát- tegyünk a vízbe az nélkül, hogy a víz koncentrációja a növény számára káros szintet meghaladja.
Gyakorlati mérések alapján 1mS/cm vezetőképesség értékü víz nagyjából 500-700 mg/L(ppm) oldott anyagot tartalmaz.
A különböző ionok különböző mértékben járulnak hozzá a vezetőképességhez. Csak a vezetőképesség értékéből nem állapítható meg az, hogy a víz amit használni szeretnénk alkalmas-e a növényeknek. Például ha 500ppm NaCl desztillált vizes oldatát használnánk növénylocsolásra az károsan befolyásolja a növényt, viszont még magasabb EC érték mellett is a csapvíz teljesen jó megoldás.
pH
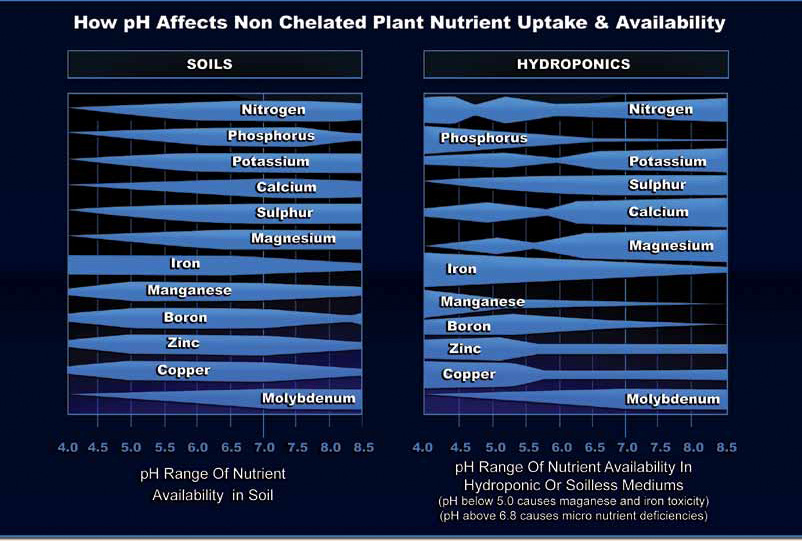
A gyökérközeg és a tápoldat kémhatása nagyban befolyásolja a növények fejlődését és aratáskori erdményét. A kémhatás befolyással bír a tápanyagok oldhatóságára és felvehetőségére. Különböző tápanyagok eltérő értéken felvehetőek a növények számára, szerencsére ezek azértékek intervallumokként értelmezhetőek és kisebb-nagyobb átfedések vannak az egyes tápelemek felvehetőségi intervallumaiban.
Általánosságban a növények minden vízben oldott tápanyagot képesek felvenni pH 5,8-6,8 értékek közt. Az anionoknak alacsonyabb, a kationoknak a magasabb pH érték kedvez.
A pH állítás a következők miatt fontos:
- Az oldat pH-ja hatással van az oldatban lévő tápanyagok felvehetőségére
- A helyes pH biztosítja, hogy a feloldott tápanyagok az oldatban nem lépnek kölcsönhatásba egymással
- A hozzáadott sav segít a víz alkalinitásának, hidrogénkarbonát tartalmának csökkentésében.
Mikor a vízbe műtrágyát juttatunk akkor azok oldódnak és ionokat képeznek a vízben. Ezek az ionok oldódáskor reakcióba lépnek a vízzel és megbontják az egyes vízmolekulákat hidrogén ionná (H+) vagy hidroxid ionná(OH-). A vízben ezen kívül is természetes állapotban találhatók további H+ és OH- ionok ami a víz természetes disszociációjának köszönhető.
H2O <=> H+ + OH-
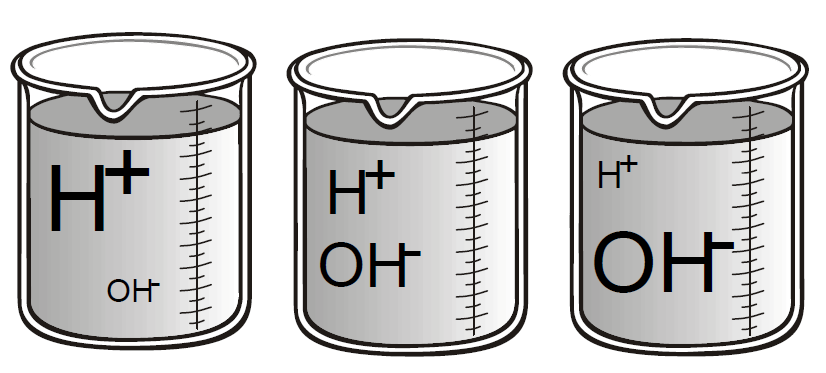 Ezek mennyisége kb. 1 : 10millió a valós vízmolekulákkal szemben. Ez 10-7 számú H+ és 10-7 számú OH- iont jelent. A molekulák mennyisége a vízben és általánosan az oldatokban változhat, azonban a hidrogénionok és hidroxidionok szorzata egyensúlyi állapotban állandó, egymás szorzata. H+ x OH-
Ezek mennyisége kb. 1 : 10millió a valós vízmolekulákkal szemben. Ez 10-7 számú H+ és 10-7 számú OH- iont jelent. A molekulák mennyisége a vízben és általánosan az oldatokban változhat, azonban a hidrogénionok és hidroxidionok szorzata egyensúlyi állapotban állandó, egymás szorzata. H+ x OH-
=KV =10-7x10-7=10-14
A szorzat értéke tehát minden körülmények között állandó, ha az egyik koncentráció értékben változás következik be, az szükségszerűen maga után vonja a másik érték változását.
A víz semleges, ha a H+ ionok és OH- ionok koncentrációja megegyezik, tehát:
[H+] = [OH-] = 10-7
- A víz savas karakterű, ha a [H+] ionok koncentrációja meghaladja a [OH-] ionok koncentrációját.
- Lúgos karakterű a víz, ha a [OH-] ionok koncentrációja haladja meg a [H+] ionok koncentrációját.
A pH fogalma és alkalmazása a savasság vagy lúgosság jellemzésére
Mivel a vízben a [H+] ionok és a [OH-] ionok koncentrációjának szorzata állandó (10-14), így elegendő az egyik koncentráció érték megmérése, abból a másik már következik. Mivel nagyon kicsiny, negatív számokról van szó, ezért az egyszerűbb kezelhetőség kedvéért egy segédfogalom került bevezetésre. Ez a segédfogalom a pH.
A pH a vízben mért [H+] ion koncentráció 10-es alapú negatív logaritmusa, azaz:
pH = -lg [H+]
A pOH a pH-hoz hasonlóan értelmezhető. Ezen segédfogalmakkal leírva a víz ionszorzata a következőképp írható fel:
pH + pOH = 14
Az előző pontban ismertetettek alapján a víz savas karakterű, ha a [H+] ion koncentrációja meghaladja a [OH-] ion koncentrációját. Fordított helyzetben a víz lúgos. Amennyiben ez a két koncentrációérték megegyezik, a víz semleges.
A pH függvényében ezen összefüggések a következőképp írhatóak fel:
pH < 7 savas rendszer
pH = 7 semleges rendszer
pH > 7 lúgos rendszer
Példa:
Ha 1 L vízben 0,1 cm3 40% töménységü HNO3-at (salétromsavat, veg pH-) (ξ=1,25g/cm3) oldunk fel, akkor mekkora lesz a víz pH-ja?
Mivel a HNO3 erős sav, ez azt jelenti, hogy szinte az összes molekula disszociálni fog a vízben. 0,1cm3 40% HNO3 0,125×0,4=0,05g 100% töménységü HNO3-nak felel meg. A salétromsav moláris tömege 63g/mol. 0,05g/63g=0,0008mol
A salétromsav a vízben H+ és NO3- ionokra bomlik, érelemszerüen mindkettő mennyisége 0,0008mol
Mivel 1 L vízről van szó, így a H+ ion koncentráció:
[H+] konc. = oldott anyag móljainak száma/az oldat térfogata = 0,0008 mól / 1L = 8×10-4 mól/L
[H+] = 8×10-12
pH = -lg [H+] = -lg [8×10-12] =3,097
Tehát a víz pH-ja savazás után: 3,1
Természetesen ez az érték teljesen semleges kémhatású és pufferhatás nélküli desztvízre vonatkozik, a valóságban az öntözésre használt vizek ellenállással rendelkeznek a savazással szemben, a pH magasabb lesz az elméleti értéknél.
Fontos tudni, hogy a savak nem mindegyike disszociál a vízben teljesen. A citromsav disszociációs értéke például sokkal alacsonyabb, jelentősen nagyobb mennyiséggel lehet csak csökkenteni az oldat kémhatását.
Az oldatokban jelen lévő HCO3- (hidrogénkarbonát ion) a savazás (hozzáadott H+) hatására szeret H2CO3-á (szénsavvá) alakulni, köszönhetően az oldat egyensúlyi állapotra való törekvésének. Ilyenkor a savval bejuttatott H+ ionok az oldat kémhatását nem, vagy csak gyengén módosítják lefelé mindaddig, amíg találnak a vízben/oldatban HCO3-iont. Ez a folyamat időben elhúzódó.
Oldat mennyiségétől és karbonáttartalmától függően órákig is tarthat amíg kialakul a végleges egyensúlyi rendszer pH-ja. Ha a savazást követően azonnal mérsz pH-t akkor valószínüleg nem a végleges pH-t méred.
HCO3- + H+ = H2CO3
A szénsav viszont koncentrációtól és külső körülményektől(hőmérséklet, nyomás, pH) függően szeret visszaalakulni bármilyen más alternatívává, ami lehet CO2 (szén-dioxid), CO3-(karbonát, csak erősebben lúgos vízben) vagy HCO3-(hidrogénkarbonát).
CO2 + H2O <=> H2CO3 <=> H+ + HCO3-
Ebbe az egyensúlyi folyamatba még erősen beleszól a légköri CO2 koncentráció, ami egyszerü felületi érintkezéssel vagy akár egy levegőztetővel is szerepet játszik, valamint tápoldatok esetén a növény gyökérközegének ioncserefolyamata. Itt a növény által felvett anionok helyére HCO3- ion kerül. A folyamatból szabad szemmel és hétköznapi ésszel annyi érzékelhető, hogy a pH savazás hatására eleinte lassan, majd hirtelen erősen csökken, majd ez a megváltozott kémhatás valamilyen szinten megpróbál az eredeti állapotra visszakúszni.
Ha van HCO3-(hidrogénkarbonát-ion) a vízben és savas hatás éri a rendszert (H+ koncentráció növekedése, azaz pH-csökkenés), akkor a hidrogénkarbonát-ionok ezt a külső pH-eltoló hatást kompenzálni képesek. Ez a víz pufferhatása. Általánosságban elmondható, hogy a pufferek feladata a pH stabilizálása a külső behatásokkal szemben. A hidrogénkarbonát a magyarországi vizekben megtalálható természetes puffer-rendszer.
A víz pufferkapacitása tehát nagymértékben járul hozzá a tápoldat kémhatásának visszaalakuláshoz, ebben elsődleges szerep jut a víz HCO3- ion koncentrációjának. A dologhoz azonban az is hozzátartozik, hogy hidrogénkarbonát mindig jelen lesz a vízben, ugyanis szükséges a víz egyensúlyi állapotához, ez nélkül a pH addig változna amíg a levegőből meg nem szerzi az oldat az igényelt mennyiséget. . Ezt a hasznosnak minősülő mennyiséget a szakkönyvek 80-120mg/L értékben határozzák meg. Ha a felhasznált vizünk ennél az értéknél magasabb akkor a két érték közti mennyiséget érdemes elősavazással semlegesíteni. Ez után keverjük be a tápot és csökkentjük tovább igény szerint az oldat kémhatását. Az így beállított tápoldatok kémhatása sem állandó, azonban nagyban csökkenthető a pH alternálása. Az elősavazáselvégzése előtt érdemes az elkészítendő tápoldatból próbakeverést készíteni, ebből látod azt, hogy a táp vízhez való keverésével milyen mértékben mozdul az oldat kémhatása.
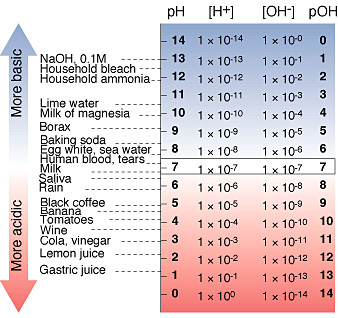 A vízben található hidrogén és hidroxid ionok arányából tehát következtetünk a pH-ra, a kémhatásra. Ha több H+ ion van a vízben mint OH- akkor savas, ha fordítva akkor lúgos kémhatású vízről beszélünk.
A vízben található hidrogén és hidroxid ionok arányából tehát következtetünk a pH-ra, a kémhatásra. Ha több H+ ion van a vízben mint OH- akkor savas, ha fordítva akkor lúgos kémhatású vízről beszélünk.
Mikor mindkettőből azonos mennyiség található a vízben akkor a víz semleges kémhatású. Mivel a növények gyökerei a pH4,5 alatti értékeket nem viselik el károsodás nélkül és a pH7,5 feletti kémhatású vizekben található tápelemek egy része felvehetetlen vagy nehezen felvehetővé válik a növények számára ezért a két érték közötti víz ill. oldat jelenti a növény számára a tolerálható értéket.
A növények többsége 5,5-6,8 közti pH-t kedveli és ebben a tartományban minden vízben oldott tápelem felvehető, így a locsolóvíz és a tápoldat kémhatását is erre az értékre érdemes állítani.
Érdemes tudni azt, hogy a pH egy értékü változása fordított logaritmikus, magyarul egy egész számnyi értékváltás esetén az oldatban lévő H+ vagy -OH ionok megtízszereződnek.
A víz vezetőképességéről és a kémhatásról itt olvashatsz bővebben,
a pH kertészeti kezeléséről meg itt
Mérőeszközök
Indikátorpapírok
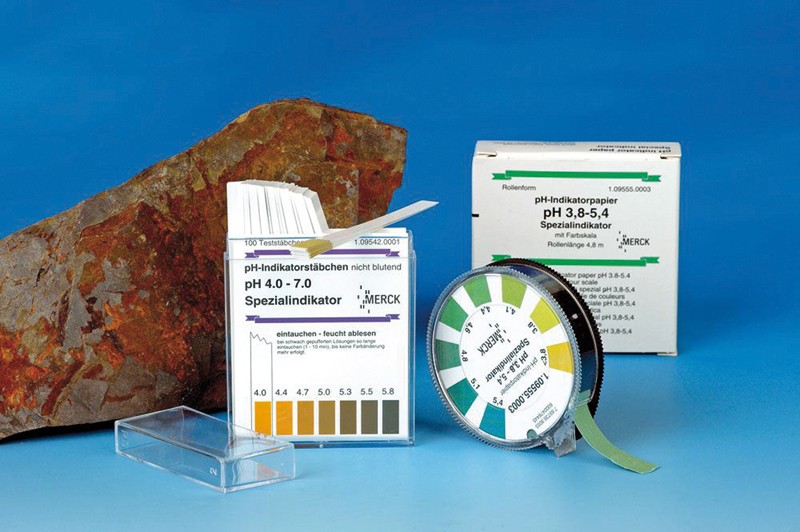 Itt gyakorlatilag szívóképes szűrőpapírokról van szó, melyek alkalmas indikátorokkal vannak impregnálva. Annak ellenére, hogy ezekkel a papírokkal általában nem lehet igazi pH mérést végezni, hanem csak egy durva pH-skála szerinti besorolásra használhatók – mégis nagynépszerűségnek örvendnek.
Itt gyakorlatilag szívóképes szűrőpapírokról van szó, melyek alkalmas indikátorokkal vannak impregnálva. Annak ellenére, hogy ezekkel a papírokkal általában nem lehet igazi pH mérést végezni, hanem csak egy durva pH-skála szerinti besorolásra használhatók – mégis nagynépszerűségnek örvendnek. Különböző méréstartományban tudnak mérni. A legegyszerübb indukátorpapírok csak az oldat savas vagy lúgos voltát határozzák meg. Egyel fejlettebb verzió a teljes pH skálát lefedő Universal papírok, amik 1-14 közt mérnek, pontosságuk miatt nemigen használjuk tápoldat és víz pH méréshez. A Special papírok a pH skála 2-3 értéknyi szakaszait fedik le, általában 0,5 érték pontossággal meghatározható velük az oldatunk kémhatása. Léteznek kettős indikátorcsíkkal (Duotest) rendelkező papírok. Mérésfinomságuk 0,3 érték körüli.
Különböző méréstartományban tudnak mérni. A legegyszerübb indukátorpapírok csak az oldat savas vagy lúgos voltát határozzák meg. Egyel fejlettebb verzió a teljes pH skálát lefedő Universal papírok, amik 1-14 közt mérnek, pontosságuk miatt nemigen használjuk tápoldat és víz pH méréshez. A Special papírok a pH skála 2-3 értéknyi szakaszait fedik le, általában 0,5 érték pontossággal meghatározható velük az oldatunk kémhatása. Léteznek kettős indikátorcsíkkal (Duotest) rendelkező papírok. Mérésfinomságuk 0,3 érték körüli.Indikátor oldatok
Az indikátorfolyadék segítségével történő kémhatás-meghatározás egyszerű: az indikátort bele kell cseppenteni a vizsgált anyagba. Az általános mennyiségarány 1-2 csepp 5 ml-hez, ha ettől eltérő mennyiséget kell alkalmazni, azt a folyadék csomagolásán feltüntetik. A kialakuló színt egy skálával kell összehasonlítani, és erről leolvasható a mért pH.
 A folyadékkal történő kémhatás-méréskor figyelembe kell venni, hogy a vizsgált folyadék rétegvastagsága befolyásolhatja az oldat kialakuló színét (vagy legalábbis annak látványát), ennek kiküszöbölésére szokták javasolni, hogy meghatározott mennyiségeket és az ezekhez szolgáló mérőedényeket alkalmazzuk (ezeket sokszor egy szettben lehet megvenni az indikátorral). Természetes megvilágításban vagy semleges mesterséges fényben lehet tiszta színképet látni.
A folyadékkal történő kémhatás-méréskor figyelembe kell venni, hogy a vizsgált folyadék rétegvastagsága befolyásolhatja az oldat kialakuló színét (vagy legalábbis annak látványát), ennek kiküszöbölésére szokták javasolni, hogy meghatározott mennyiségeket és az ezekhez szolgáló mérőedényeket alkalmazzuk (ezeket sokszor egy szettben lehet megvenni az indikátorral). Természetes megvilágításban vagy semleges mesterséges fényben lehet tiszta színképet látni.
Az egyes folyadékindikátorok a legtöbb esetben nem fogják át a teljes skálát, vagyis csak tartományokban alkalmasak pH érték mérésére. Ezeken belül azonban igen pontosak: a hozzájuk alkalmazott skála beosztása a legtöbbször 0,5. Nagy hátránya, hogy csak teljesen üledékmentes és színtelen folyadékokat lehet vele vizsgálni, talajminta kémhatásának vizsgálatára nem alkalmas. Ára valahol 2kFt körül van. Hasonlóan az indikátorpapírokhoz ez is sokkal inkább a közeg és és tápoldat pH-jának ellenőrzésére jó mint a tizedpontos beállításhoz. Arra van müszer.
Elektromos pH mérő
A digitális pH mérő eszközök előnye a másik kettő mérési móddal szemben elsősorban az, hogy a használójának nem kell döntést hoznia az érték megállapításához, megteszi ezt a müszer. Nincs pontatlan leolvasás, nem kell a folyadék hőmérsékletének 25C-nak lennie és más hibára adó okot(pl kation többlet) kiküszöböl automatikusan. Szintén nagy előny, hogy mozgó alkatrész nincs rajta, fizikailag nehéz tönkretenni.
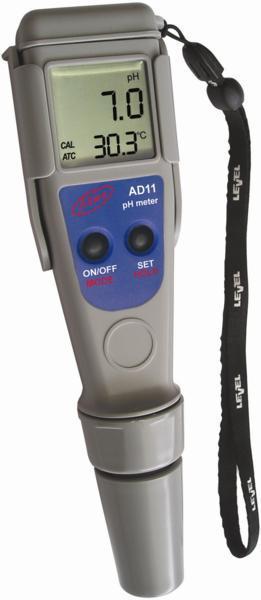 Hátránya, hogy mérés előtt kalibrálni kell a müszert a valószínü tartományon belül. Elsőként lényeges, hogy a precíz mérés elvégzéséhez kétpontos kalibrálással kezdjünk. A pH mérő műszer beállítása során olyan puffer oldatot alkalmazzunk, melynek kémhatása nem mutat nagyobb különbséget a mérni kívánt egységtől, mint három pH. Lényeges még, hogy az adott minta pH-értéke a két kalibrálni kívánt puffer értéke között legyen. Minden mérést követően javasolt a vezetőképesség mérő elektródájának leöblítése. Ezután következik a mérés, egyszerüen bele kell tunkolni a készüléket a vizsgálni kívánt folyadékba.
Hátránya, hogy mérés előtt kalibrálni kell a müszert a valószínü tartományon belül. Elsőként lényeges, hogy a precíz mérés elvégzéséhez kétpontos kalibrálással kezdjünk. A pH mérő műszer beállítása során olyan puffer oldatot alkalmazzunk, melynek kémhatása nem mutat nagyobb különbséget a mérni kívánt egységtől, mint három pH. Lényeges még, hogy az adott minta pH-értéke a két kalibrálni kívánt puffer értéke között legyen. Minden mérést követően javasolt a vezetőképesség mérő elektródájának leöblítése. Ezután következik a mérés, egyszerüen bele kell tunkolni a készüléket a vizsgálni kívánt folyadékba.
A régebbi, olcsó típusok még nem voltak automata kalibráló funkcióval ellátva, egy csavarral kellett a megfelelő értékre állítani miután a pufferoldatba mártották. Az újabb készülékeken már ezt egy gombnyomással elvégezhetjük.
Szintén hátránya az, hogy a mérést végző üvegelektróda viszonylag könnyen megsérülhet egy véletlen leejtés miatt. Az üvegelektróda ezen kívül érzékeny a kiszáradásra is, legtöbbször így tesznek tönkre phmérőt a userek. A müszer védőkalapja egyben azt a célt is szolgálja, hogy a benne lévő szivacsot nedvesen lehessen tartani vagy folyadékot is tárolva benne az üvegelektróda nedves maradjon.
Szinte minden újabb készülék automata hőmérséklet-kompenzáció funkcióval van ellátva, nem kell figyelembe venni a folyadék hőmérsékletét. Méréshatáruk teljesen fedi a pH skálát. Készülékenként eltérő a méréspontosságuk. Általában 1-2 tizedes pontossággal mérnek 0,1 érték hibahatáron belül. Számunkra a 0,1 érték pontos müszer tökéletesen megteszi. Fontos, hogy a müszer vízálló legyen, ezt szinte minden müszer tudja.
 A pH mérő készülék élettartama nem végtelen, az üvegelektróda megrepedése vagy kiszáradása esetén cserét érdemel. A drágább készülékek üvegelektródái cserélhetők de azok sem olcsók. Kapható kombinált EC-pH mérő. Én nem érzem hasznát, árban nem olcsóbb mint két külön készülék.
A pH mérő készülék élettartama nem végtelen, az üvegelektróda megrepedése vagy kiszáradása esetén cserét érdemel. A drágább készülékek üvegelektródái cserélhetők de azok sem olcsók. Kapható kombinált EC-pH mérő. Én nem érzem hasznát, árban nem olcsóbb mint két külön készülék.
Nagyobb mennyiségü (>100L) tápoldat vagy keverővíz esetén érdemes pH monitort vásárolni, ennek a mérőelektródája állandóan a folyadékban van és készülékenként eltérő módon, de képes jelezni a savadagolónak ha az optimum értékből kilép az oldat pH-ja.
Áruk felszereltségtől, méréspontosságuktól függ, használható müszert nehéz kapni 10-12kFt alatt. Ehhez az árhoz még hozzá kell számolni a kalibráló és tárolófolyadék árát is.
Szerintem pH mérő müszerre annak van szüksége aki hidrokulturában tartósan gondolkodik. Két letermett hidrokör után visszatérni talajos termesztésre egyet jelent azzal, hogy a müszer a szekrény mélyén fog kiszáradni. Talajos termesztéshez vagy napi tápoldatos locsoláshoz az indikátor papír vagy a folyadék is teljesen megfelel, talán még kényelmesebb is.
Kísérő ionok
A víz szervetlen ionjai közül vannak hasznos és káros ionok is. Amit a növény tápanyagként tud hasznosítani az hasznos, ami a hasznos ionok felvételét akadályozza vagy versenyez vele, esetleg méregként hat az káros.
- A víz keménységét meghatározó Ca++ és Mg++ ionok, a NO3-(nitrát), K+, SO4–(szulfát) és PO4—(foszfát)ionok a növény számára hasznosak és felvehetők, tápoldat készítéskor mennyiségeiket számításba szokták venni.
- A víz Fe (vas), Mn(mangán), Cl- (klór), Na+(nátrium) és HCO3-(hidrogénkarbonát) ionjai a növény számára mennyiségüktől függően káros, vagy a jelenlétük nem kívánatos.
A hasznosítható ionok szerepét talán nem kell túlragozni, a növény felveszi és hasznosítja őket. A beltéritermesztésben leggyakrabban használt csapvízben a kalcium és magnézium mennyisége szokott magas szintü lenni, de tápoldatozáskor a csapvízben található mennyiség még nem fedezi a növény igényeit, kiegészítésre szorul. A kalcium és magnéziumtartalom adja meg a víz keménységét,ez elsősorban a mütrágyák oldhatóságát befolyásolja.
A vas és mangántartalom a csapvízben gyakran magas, ez elsősorban csepegtető öntözésnél probléma, oxidálódva oldhatatlan csapadékot tud képezni és a csepegtetőtesteket eltömíti. A víz vastartalma egyszerü levegőztetéssel csökkenthető.
A klór és nátriumtartalom szintén magas tud lenni a csapvizekben azonban ha a mennyiségük nem haladja meg az 2-3 mM/L értéket akkor napi szintü tápoldatozásnál gond nélkül alkalmazható a víz. Zárt rendszerü hidrokultúrás termesztésnél ez a határérték sokkal feszesebb.
A víz hidrogénkarbonát tartalma a víz és vele a tápoldat kémhatására, illetve annak beállítására van negatív hatással. A savazással bejuttatott H+ ionok első lépésben a HCO3- ionokkal lépnek kölcsönhatásba, pufferként viselkednek. Hasonlóan viselkednek a gyökérkörnyezetben is. Általánosan elfogadott a 2mM/L mennyiség a keverővízben. Mennyisége salétromsav(HNO3) hozzáadásával csökkenthető. A sav egységnyi mennyisége azonos mennyiségü hidrogénkarbonátiont semlegesít és helyettesíti azt nitrátionnal (NO3-).
A hidrogénkarbonát-ion semlegesítéséhez szükséges sav mennyisége könnyen számítható.
1 cm3 60% HNO3(salétromsav), aminek a sürüsége 1,37 g/cm3 822mg tiszta, elemi salétromsavnak felel meg.
A HNO3 moláris tömege 63g, a hidrogénkarbonáté 61g.
63/822 =61/x ——- x=800mg
Ez egy liter víznek kicsit durva, de ha 1cm3 60%-os salétromsavat 10L vízhez teszem akkor a víz hidrogénkarbonát mennyiségét lecsökkentem 80mg/L értékkel. A kiütött HCO3- ionok helyére nitrátion kerül, ami a növény számára azonnal felvehető nitrogénforrás.
A salétromsav (63g/mol)
- 1 mol nitrogént (moláris tömege 14g)
- 3 mol oxigént (moláris tömege 16g, összesen 3×16=48g)
- és 1 mol hidrogént (moláris tömege 1g) tartalmaz
A nitrogén aránya a salétromsavon belül: 14g/63g=22% Innentől könnyen számítható, hogy a bevitt 822mg 22%-a 182mg, így literenként 18mg nitrogént adok a vízhez 0,1cm3/L savazással.
Ha ugyan ezt 60% foszforsavval teszem akkor 55mg/L-el csökken a víz hidrogénkarbonát tartalma és 27mg/L-el nől a foszfortartalma. 10L vízhez 2cm3 60%-os foszforsavat téve gyakorlatilag a növény komplett foszforigénye fedezhető a termesztés teljes időszakában.
A savazással bevitt tápanyagtartalommal mindig számolni kell.
A víz kísérőionjainak mennyiségére labor nélkül csak következtetni lehet, azonban az ioncserélt (a vízben található anionokat OH- ra, kationokat H+ ra cseréli) és fordított ozmózissal tisztított vizek minimális iontartalommal rendelkeznek. Ezzel együtt jár az is, hogy pufferképességük minimális, viszonylag könnyen állítódik el a kémhatásuk. Gyakran hasznos, ha ezeket a vizeket csapvízzel keverjük. Ilyenkor a sótartalmuk ugyan megnől, viszont a bejuttatott HCO3- ionoknak köszönhetően jobban ellenállnak a környezet befolyásolásának, stabilabb marad a pH.
A csapvizek oldott anyag tartalmáról a helyi vízszolgáltató valamilyen formában jelentést ad a honlapján, érdemes itt tájékozódni. Gyakran a nátriumtartalom kimarad a kísérőion tartalom felsorolásból. A víz magnézium és kalciumtartalmát egységesen keménységi fokban adják meg. Ez egy származtatott mértékegység ami a kalciumion és magnéziumion tartalom mg/L-ben mért összegének tizede. Talaj és vízlaborokban komplett vízvizsgálat kérhető. Nem olcsó, viszont ha valaki pontosan akarja ismerni a víz kísérőion tartalmát akkor érdemes lehet megcsináltatni. Ha zárt rendszerü hidrokultúrás termesztést tervez valaki csapvíz vagy kútvíz teljes vagy részleges használatával akkor ajánlott a vizsgálat elvégzése. Akvarisztikával foglalkozó boltokban kapható vízkeménység és karbonát teszt.
A vízminőséget jellemezni a vezetőképesség, a kémhatás, a hasznos és káros ionok összmennyiségével lehet, szeparált vizsgálat nem ad jó képet az öntözővíz minőségéről. A cél viszont azonos, mint ami az EC cikkben is le van írva, lehetőleg
- legyen minél alacsonyabb vezetőképességü, minél kevesebb oldott anyagot tartalmazzon
- a pH semleges közeli legyen, egy egységnyi eltérés ettől fel vagy le még nem javíthatatlan.
- minél kevesebb HCO3- iont tartalmazzon, azonban 300mg/L mennyiség még könnyen feldolgozható
- A kalcium és magnéziumtartalom felvehető tápanyag a növénynek de nagyobb mennyiségben megnehezíti a kívánt tápoldatrecept elkészítését.
- Klór és nátrium minél kevesebb legyen benne
Oldatok számításához szükséges alapismeretek
Van néhány mértékegység aminek a megértése alapvetően szükséges az oldatok koncentrációjának számításához és néhány, amivel csak azok fognak többször találkozni akik komolyabban belemásznak a tápoldatkészítés rejtelmeibe.
Tömegszázalék
tömegszázalék (m%, m/m%) = oldott anyag tömege (g) / oldat tömege (g)
A tömegszázalék azt adja meg, hogy 100 g oldatban hány g oldott anyag található.
Példa:
Hány tömegszázalékos az a konyhasóoldat, amelyben 10 g konyhasó és 90 g víz található?
Oldott anyag tömege: 10g
Oldat tömege: 10g + 90g = 100g
Tömegszázalék értéke: m% = 10g / 100g = 0,10 = 10 %
Térfogatszázalék
térfogatszázalék (tf%,V%) = oldott anyag térfogata (cm3) / oldat térfogata (cm3)
A térfogatszázalék azt adja meg, hogy 100 cm3 oldatban hány cm3 oldott anyag található.
Példa:
100 cm3 oldatban található 40 cm3 alkohol 40 tf%-os, hiszen:
Térfogatszázalék értéke: tf% = 40 cm3 / 100 cm3 = 0,4 = 40 %
Vegyesszázalék
vegyesszázalék (v%, m/V%) = oldott anyag tömege (g) / oldat térfogata (mL)
A vegyesszázalék azt adja meg, hogy egységnyi (L, mL) oldatban hány g oldott anyag található.
A vegyesszázalékhoz hasonló koncentráció érték használatos a vízkémiában, ahol a koncentráció értékek általában g/cm3; mg/L; μg/L; értékekben adottak.
Példa:
10L oldatban található 12 g MKP (monokálium-foszfát)
Térfogatszázalék értéke: tf% = 12g /10L =1,2 %
A 12g szárazanyag az oldatban 12000mg-nak felel meg, így 1200mg/L az oldat koncentrációja.
(A vegyesszázalék témához nem tartozik szorosan de jó tudni azt, hogy a MKP 52% P2O5 és 34% K2O tartalommal bír. A kálium oxid 83%-a elemi K-t, a foszforpentoxid 44%-a tiszta foszfor.
1200×0,54×0,44=273mg P
1200×0,34×0,83=339mg K
Ez kültérben nyár második felében virágzásindításhoz pont jó mennyiség egy gerilla növényhez. Ugyan ez a mennyiség beltérben, cserépben közel biztosan túltáp.)
TDS, ppm, mg/L
A TDS (Total Dissolved Solids, összes oldott szilárd anyag) mértékegysége. Amerikában a ppm-et használják nálunk a mg/l. AZ EC-ből csak következtetni lehet az összes oldott szilárd anyag (TDS) tartalomra, tehát az oldat töménységére – koncentrációjára, mivel a különböző oldott anyagok, elemek, ionok vezetőképessége eltér, ezért a valódi értékeket csak megbecsülni lehet.
1mg/l = 1ppm
mol, mmol, mM/L
A molt talán nem kell bemutatni, 6×1023 számú azonos kémiai elem mennyisége. A különböző elemeknek a moláris mennyisége megegyezik de eltérő a moláris tömegük.
A mmol -millimol- az elem moláris tömegének ezredrésze. Ha ezt az ezredmolnyi kémiai elemet feloldom egy liter vízben akkor az oldat koncentrációja 1mmol/L lesz.
mgeé, mgeé=L
A kémiai egyenérték az elemeknek (ionoknak) azokat a mennyiségeit adja meg, amelyek egymással kémiai kötésbe lépnek, ill. vegyületeikben egymást helyettesíteni képesek. Egy ion egyenértéktömege = atomtömeg/vegyérték
Bonyolult, mi? Az atomtömeget kezeld moláris tömegként. Az elemek vegyértéke pedig az ionos formán a szabad gyökök száma. Hidrogén (H+), kálium (K+), klór (Cl-), nátrium (Na+) esetén ez a szám egy. Kalcium (Ca++), magnézium (Mg++), szulfát(SO4–) esetén kettő. Foszfátion (PO4—) esetén három.
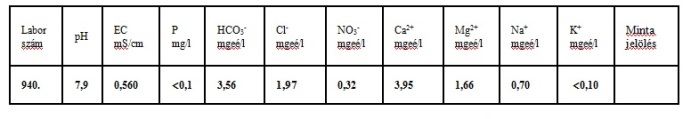
Biztos dübörög benned a kérdés, hogy ez hány gramm pluszt jelent aratáskor. Semmit. Használni valószínüleg 3 esetben fogod. Mikor kikérsz egy vízlabor vizsgálatot és annyit látsz, hogy
a vízben található Ca tartalom 3,56mgeé/L.
A kalcium két szabad gyökkel rendelkezik. A kalcium moláris tömege 40g.
3,56×40/2=71mg/L
Továbbá hasznos mgeé-ben számolni akkor, mikor a végleges kijutatandó tápoldatreceptnél ellenőrzöd az ionegyensúlyt. Szintén ebben kell gondolkodni mikor a talajok kationcserélő képessége kerül majd szóba. A lényege az, hogy a nagyobb vegyértékü elemek erősebb kötéssel bírnak, ha a töltések egyensúlya fontos egy oldatban akkor ezzel is kell számolni.


Visszajelzés: Tápanyagellátás beltérben III. | exkalapalatt
Visszajelzés: Tápanyagellátás beltérben IV | exkalapalatt
kifolyik a szemem..oszt még van 2 rész